1.Click the button below to copy the WeChat
Click to copy wechat
Jiangsu Aisulai Biotechnology Co., LTD
双电源系统、双重备份方案、灾难恢复系统、Rotronic温湿度在线管理和实时监控报警系统、电子化样品管理系统
优选运输方案(货运运输、专车运输、航空运输),可实现运输过程中的温度控制
稳定性研究基于cGMP/ChP/FDA/ICH/WHO等指导原则,符合GMP规范和FDA 21CFR Part 11数据完整性要求
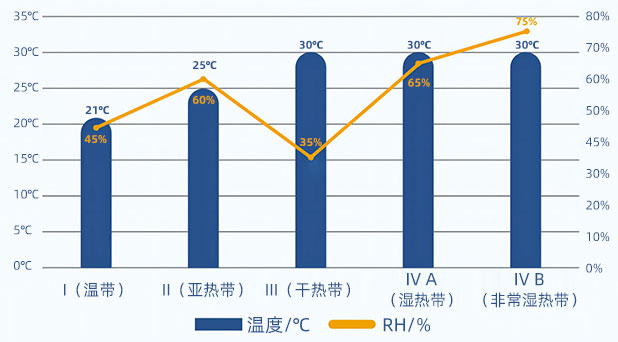
| 影响因素试验条件 | |
| 高温试验条 | 高于加速试验温度10℃以上(如50℃、60℃等) |
| 高湿试验条件 | 25℃±2℃ 90%±5℃/75%RH±5%RH |
| 强光照射试验条件 | 总照度不低于1.2×106Lux:hr,近紫外能量不低于200w-hr/m2 |
| 冻融循环条件 | -30℃~55℃ |
| 存储条件 | 原料药/制剂(一般情况) | 原料药/制剂(拟冷藏) | 原料药/制剂 (拟冷冻贮藏) | 半渗透容器制剂 |
| 长期试验条件 | 25℃±2℃/60% RH±5%RH或30℃±2℃/65%RH±5%RH | 5℃±3℃ | -20℃±5℃-70℃/-80℃±10℃ | 25℃±2℃/40%RH±5%RH或30℃±2℃/35%RH±5%RH |
| 中间试验条件 | 30℃±2℃/65%RH±5%RH | 30℃±2℃/65%RH±5%RH | ||
| 加速试验条件 | 40℃±2℃/75%RH±5%RH | 25℃±2℃60%RH±5%RH | 40℃±2℃(NMT)25%RH |
1. WHO Technical Report Series, No.953,2009 Appendix 1
2. 中国药典2020版:9001原料药物与制剂稳定性试验指导原则
3. ICH Q1A(R2)新原料药和制剂的稳定性试验
4. ICH Q1B稳定性试验:新原料药和制剂的光稳定性试验
问卷评估

研究设计阶段
安全运输合规接收
样品运输及接收阶段
可控存放

样品存储阶段
准时取出合规测试
取样测试阶段
稳定性报告交付

数据递交阶段
● ICH,2003.02.06,Q1A~Q1F Stability
● NMPA,2015.02,化学药物(原料药和制剂)稳定性研究技术指导原则
● NMPA ,2015.04,生物制品稳定性研究技术指导原则(试行)
● CDE,2016.09,已上市化学药品变更研究的技术指导原则
● FDA,2008.11,Drug Stability Guidelines
● EMA,2015.03.30,EU Guidelines for GMP for Medicinal Products for Human and Veterinary Use Part 1 Chapter 6: Quality Control
● 药品生产质量管理规范 ,2010,第64,135,162,225,231~239章节
● 药品GMP指南,2011.06,质量控制实验室与物料系统14稳定性试验
● WHO,2016.07,Stability testing of active pharmaceutical ingredients and finished pharmaceutical products Annex 10
● USP,现行版,